ЭКМО и удаление цитокинов для поддержки пациента с ишемическим дефектом межжелудочковой перегородки в ожидании хирургического вмешательства – отчет о клиническом случае
ECMO and Cytokine Removal for Bridging to Surgery in a Patient with Ischemic Ventricular Septal Defect – a Case Report
Стефани Марек (Stephanie Marek)1,2, Гуннар Гампер (Gunnar Gamper)1,2, Георг Райнинг (Georg Reining)1,2, Питер Бергманн (Peter Bergmann)3, Харальд Майр (Harald Mayr)1,2, Андреас Клигель (Andreas Kliegel)1,2
1 Общество Карла Ландштайнера (Karl Landsteiner Society) – Исследовательский институт сердечно-сосудистых заболеваний и аритмий, Санкт-Пельтен, Австрия
2 Университетская больница Санкт-Пельтена, отделение кардиологии, Санкт-Пельтен, Австрия
3 Университетская больница Санкт-Пельтена, отделение кардиохирургии, Санкт-Пельтен, Австрия
Опубликовано в журнале Int J Artif Organs 2017; 00(00): 000-000
DOI:10.5301/ijao.5000600
Краткое изложение
Постинфарктный дефект межжелудочковой перегородки (ДМЖП) остается серьезным и зачастую летальным осложнением даже при современном развитии чрескожных коронарных вмешательств. Является ли немедленное или отложенное хирургическое вмешательство с применением внутриаортальной баллонной контрпульсации оптимальной стратегией в подобных случаях, остается под вопросом. В таких ситуациях требуется междисциплинарный подход, объединяющий интенсивистов и кардиохирургов. В настоящей публикации мы даем отчет о применении вено-артериальной экстракорпоральной мембранной оксигенации (ЭКМО) и экстракорпоральной очистки крови (CytoSorb) в качестве метода поддержки пациента в ожидании хирургического вмешательства. Диагнозы пациента: ишемический ДМЖП, результирующий в затяжной кардиогенный шок после нижнего инфаркта миокарда.
Ключевые слова: кардиогенный шок, инфаркт миокарда с повышением ST-сегмента, вено-артериальная экстракорпоральная мембранная оксигенация (ЭКМО), дефект межжелудочковой перегородки (ДМЖП), кардиохирургия
Введение
Постинфарктный дефект межжелудочковой перегородки (ДМЖП) – редкое, но зачастую летальное осложнение инфаркта миокарда (1-2). Частота возникновения постинфарктного ДМЖП оценивается от 1% до 2% (1,3), уровень смертности достигает 90% у пациентов при консервативном лечении и от 15% до 60% при хирургической коррекции (1,3-5). Пациенты с кардиогенным шоком и ДМЖП оцениваются как имеющие более высокий риск смертности по сравнению с пациентами с другими осложнениями острого инфаркта миокарда (5). Зачастую для снижения постнагрузки левого желудочка и шунтирования слева направо при ишемическом ДМЖП для стабилизации пациента в ожидании кардиохирургического вмешательства используется внутриаортальная баллонная контрпульсация. В отчетах о нескольких клинических случаях пациенты с кардиогенным шоком после инфаркта миокарда получали поддержку ЭКМО в качестве мер ведения до операции. Эти клинические случаи демонстрировали положительные результаты (6-9). В последнее время вено-артериальную ЭКМО (ваЭКМО) все чаще применяют для коррекции гемодинамически нестабильных пациентов (10). В отличие от большого количества данных по применению ваЭКМО у педиатрических пациентов с врожденными пороками сердца данные по ЭКМО у взрослых пациентов с ишемическим ДМЖП, ожидающих операции, встречаются достаточно редко (7).
Методы и результаты
Пациент: мужчина, 64 года (индекс массы тела 29 кг/ м2), в анамнезе нижний инфаркт миокарда с повышением ST-сегмента. До этого история болезни не насчитывала серьезных заболеваний, гипертензия и диабет не диагностированы (глюкоза 147 мг/дл). Лекарственных препаратов на момент поступления не принимал. Факторами риска с точки зрения сердечно-сосудистой системы можно считать тучность и никотиновую зависимость (50 пачек в год). Анализ крови подтвердил нормальную функцию почек (клубочковая фильтрация > 60 мл/мин). Общий холестерин 172 мг/дл (LDL 120 мг/дл). Пациент поступил в больницу через 3 часа после развития симптоматики, в сознании, состояние стабильное: давление 101/77 мм рт.ст., ЧСС 76/мин., сатурация 95%. Назначен аспирин и клопидогрел. Эхокардиография выявила акинезию нижней стенки и гипокинезию межжелудочковой перегородки. Коронарная ангиография установила дисфункцию 2 сосудов и дефект, вызвавший острое состояние: проксимальную окклюзию правой коронарной артерии. Неотложное чрескожное коронарное вмешательство было неудачным, и пациента перевели в наш центр.
На этой стадии пациенту была выполнена седация, он был интубирован и находился в состоянии кардиогенного шока с потребностью в вазопрессорной поддержке (норэпинефрин 0.6 мкг/кг в минуту). В конце концов правую коронарную артерию удалось реваскуляризировать. Тем не менее, пациент оставался в состоянии кардиогенного шока; среднее артериальное давление (САД) 50 мм рт.ст., медленный AB ритм. После неудачного чрескожного коронарного вмешательства был установлен временный водитель ритма и внутриаортальный баллонный контрпульсатор. В отделении интенсивной терапии стабилизировать пациента не удавалось (SaO2 80%; САД 50 мм рт.ст., 80 стимулированная ЧСС 80 уд/мин.). Первичная эхокардиограмма в ОИТ не выявила релевантной клапанной утечки или шунта.
Тем временем, у пациента развился декомпенсированный шок, острое повреждение почек, метаболический ацидоз (pH 6.9, бикарбонат < 10 ммоль/л, лактат > 15 ммоль/л), была начата постоянная гемодиафильтрация. В первую ночь после чрескожного коронарного вмешательства у пациента развилась фибрилляция желудочков, ему была проведена сердечно-легочная реанимация. Через 25 минут удалось восстановить спонтанную циркуляцию. К этому времени пациенту требовались значительные дозировки вазопрессоров и инотропов (норэпинефрин до 1 мкг/кг в минуту, добутамин около 10 мкг/кг/минуту, вазопрессин 3 ЕД/час.
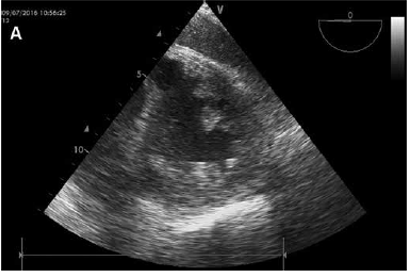
Так как пациент продолжал находиться в состоянии рефрактерного шока, электрокардиограмму повторили. На ней снова выявлен ДМЖП. Для проведения гемодинамического мониторинга в присутствии ДМЖП мы разместили катетер в легочной артерии и провели измерения газов крови в верхней полой вене, правом предсердии (ПП), правом желудочке (ПЖ) и легочной артерии (ЛА). Измерения показали значительное повышение сатурации между ПП (52%) и ПЖ (71%). Трансэзофагеальная эхокардиография (ТЭЭ) подтвердила ДМЖП размером 15 мм с обширным шунтом слева-направо, расположенным в базальной задней части межжелудочковой перегородки (Рис. 1). Глобальная сократимость левого желудочка была сохранена, однако ПЖ был увеличен в размерах и демонстрировал крайне сниженную функциональность. После консультации с кардиохирургами мы отложили вмешательство до стабилизации пациента ввиду высокого риска интраоперационной смертности. У пациента развилась частичная ишемия левой нижней конечности в месте ввода катетера интрааортальной баллонной помы. Было принято решение о хирургической имплантации ЭКМО с канюляцией правой подключичной артерии. В связи с этим решением выполнено удаление интрааортального баллонного контрпульсатора для нивелирования опасности для левой нижней конечности. Применение ваЭКМО рассматривалось как мера ведения пациента до операции. Начальная скорость кровотока ЭКМО составляла 4 л/мин. Кардиогенный шок осложнялся тяжелым синдромом системного воспалительного ответа (ССВО), поэтому проводилась дополнительная экстракорпоральная очистка крови с помощью CytoSorb (CytoSorbentsTM). Адсорбер был установлен в магистрали контура гемодиафильтрации (скорость кровотока 120 мл/мин.). Каждый CytoSorb работал в контуре по 24 часа, всего было использовано 4 адсорбера.
Из-за рецидивирующего фарингеального кровотечения антикоагуляция гепарином была титрирована до АЧТВ 50-70 секунд; при скорости кровотока 4 л/мин тромбообразование в контуре ЭКМО было маловероятным. Во избежание тромбирования контура гемодиафильтрации мы добавили цитратную антикоагуляцию. К счастью, через несколько часов после начала ЭКМО и экстракорпоральной очистки крови состояние пациента начало стабилизироваться, в течение первых 36 часов подобной терапии дозировки катехоламинов удалось значительно снизить.
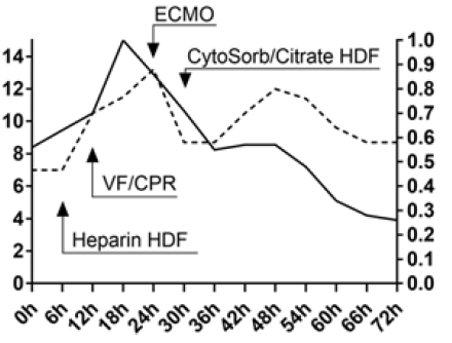
Дозировку норэпинефрина удалось сократить более чем вдвое (с 0.86 до 0.38 мкг/кг/мин), добутамин с 13.2 до 9.6 мкг/кг/мин, вазопрессин возможно стало полностью отменить (Рис.2). Основные показатели жизнедеятельности имели положительную динамику. Систолическое артериальное давление повысилось с 55 до 75 мм рт.ст., САД с 50 до 70 мм рт.ст. Через четверо суток работы ваЭМКО и применения CytoSorb пациент стал достаточно стабилен для проведения оперативного вмешательства. К этому времени дозировка норэпинефрина составляла 0.22 мкг/кг/мин, добутамина 8.7 мкг/кг/мин. Операция по коррекции ДМЖП и левого внутреннего шунта маммарной артерии была успешно выполнена 6 суток спустя после инфаркта миокарда. Пациент вернулся в отделение интенсивной терапии в стабильном состоянии.
Во время операции пациент перенес существенную потерю крови, было проведено несколько переливаний, фибриноген, плазма крови, тромбоциты и рекомбинантный фактор VIIа замещались до достижения стабилизации. Контрольная постоперационная ТЭЭ не выявила признаков ДМЖП или существенного перикадиального выпота. В течение следующих нескольких суток мы постепенно снижали поток ЭКМО до 2 л/мин. Через 13 суток скорость ЭКМО была снижена до 0.5 л/мин под постоянным контролем ТЭЭ. Практически без поддержки ЭКМО изменений в функционировании ПЖ не было зафиксировано. Его состояние значительно улучшилось, он был всего лишь слегка уменьшен. Перед удалением канюль ЭКМО в течение 24 часов пациент получал левосимендан. В конечном итоге через 17 суток после имплантации катетеры ЭКМО были успешно удалены, начато отлучение от вентилятора. Пациент хорошо перенес удаление ваЭКМО и оставался в стабильном состоянии в течение последующих дней с удовлетворительной функцией миокарда. К сожалению, во время дальнейшего пребывания в ОРИТ у пациента развился грибковый сепсис, и он скончался от рефрактерного септического шока. При этом повторная эхокардиография продемонстрировала стабильное функционирование сердца и отсутствие шунта. Это было подтверждено на вскрытии: ДМЖП был полностью закрыт.
 |
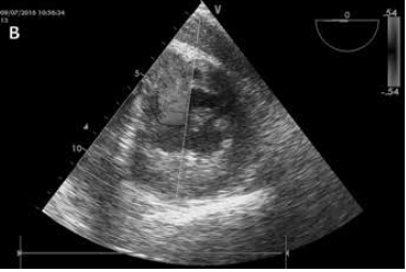 |
Рис. 1 – Эхокардиография без (А) и с (B) цветным допплером, иллюстрирующая ДМЖП.
 |
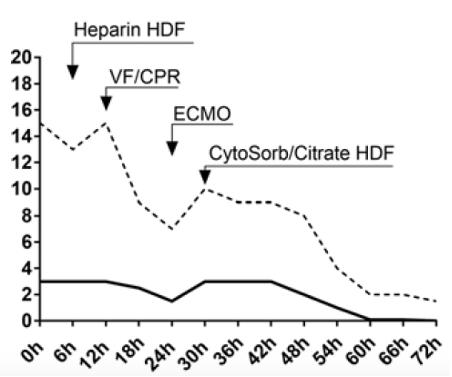 |
Рис. 2 – Тренды вазопрессоров, иноторопов и лактата.
Выводы
Насколько нам известно, это первый отчет о терапии пациента с ДМЖП в состоянии кардиогенного шока с обширным ССВО с помощью комбинации ваЭКМО и терапии CytoSorb. Частота возникновения ишемического ДМЖП значительно снизилась с начала эры тромболитической терапии инфаркта миокарда (3,12,13). Тем не менее, смертность от этого заболевания остается самой высокой по сравнению с другими осложнениями инфаркта миокарда (5). К сожалению, выбор оптимального времени для проведения вмешательства все еще остается под вопросом (4,12,13). Есть исследования, рекомендующие раннее вмешательство у гемодинамически нестабильных пациентов в сравнении с более поздним вмешательством у стабильных больных (1,2,4,12,13). В большинстве исследований возникновение кардиогенного шока является независимым предиктором смертности и, таким образом, достижение гемодинамической стабильности перед вмешательством может быть эффективно (4,5,7,13). С другой стороны, размер ДМЖП тоже представляется важным фактором (1,7,12). Кроме этого, обширный инфаркт миокарда, особенно с повреждением ПЖ, является доказанным фактором риска, ведущим к возникновению ДМЖП (3).
Хотя в литературе встречаются различные рекомендации по выбору корректного времени начала вмешательства, в клинической практике зачастую применить их невозможно. Для нашего пациента с обширным инфарктом миокарда, крупным дефектом задней части межжелудочковой перегородки и значительным снижением функции ПЖ при кардиогенном шоке в литературе рекомендуется раннее вмешательство. Тем не менее, состояние пациента было настолько нестабильным, что проведение хирургического вмешательства не представлялась возможным, а ВАБК пришлось прекратить ввиду ишемии нижней конечности.
Как и у других пациентов с декомпенсированным шоком, тяжелый ССВО развился у нашего пациента в течение первых нескольких суток после инфаркта миокарда. ССВО форсирует гемодинамическую нестабильность и ведет к полиорганной недостаточности (ПОН) (14). ССВО по сути представляет из себя массивное перепроизводство цитокинов, вызывающее чрезмерный воспалительный ответ (14). Потенциальной терапией ССВО и циркуляторного коллапса является терапевтический плазмаобмен (15). Тем не менее, к настоящему времени разработаны более современные методики экстракорпоральной детоксикации, целью которых является удаление цитокинов среднего молекулярного веса (около 10 – 55 кДа) путем гемоадсорбции (16). Другая недавняя публикация отчета о клиническом случае продемонстрировала иные положительные эффекты CytoSorb, влияющие на проницаемость эндотелия и указывающие на защиту функций сосудистого барьера (17). К тому же, свежие серии клинических случаев, рассматривающие CytoSorb в качестве терапии септического шока, продемонстрировали снижение смертности при использовании адсорбера на ранних стадиях заболевания, а также значительное снижение потребности в катехоламинах и сокращение концентрации лактата, что полностью совпадает с результатами клинического случая, описываемого нами (16).
Количество данных о применении этого нового метода экстракорпоральной детоксикации для пациентов с кардиогенным шоком остается небольшим (18-20). В нашем случае мы комбинировали ваЭКМО с экстракорпоральной детоксикацией, хотя в литературе прошлых лет в качестве метода ведения пациента в ожидании хирургического вмешательства шла речь только о применении устройства для поддержки желудочков (7, 10-12). У детей с врожденными пороками сердца применение ваЭКМО представляет собой часто используемый и хорошо изученный метод работы в преддверии хирургического вмешательства, однако, у взрослых применение ЭКМО описано всего в нескольких отчетах о клинических случаях. Данные о комбинации ЭКМО с экстракорпоральной детоксикацией практически отсутствуют (7-9,18).
Rohn et al опубликовали клинический случай, посвященный работе с 62-летней пациенткой с кардиогенным шоком на фоне отказа обоих желудочков после нижнего инфаркта миокарда. Ввиду нестабильного состояния пациентки сразу после чрескожного коронарного вмешательства была имплантирована внутриаортальная баллонная помпа, назначены инотропы. Этих мер оказалось недостаточно, была начата процедура ваЭКМО. Это привело к стабилизации пациентки и возможности провести оперативное вмешательство спустя 3 суток. В конечном итоге через 2 месяца пациентку выписали в удовлетворительном состоянии (8). Gregoric et al описывали случай с 54-летней пациенткой с постинфарктным ДМЖП, которой было имплантирован чрескожное устройство поддержки желудочков. После ухудшения состояния, СЛР на фоне вторичного разрыва правого желудочка в ожидании хирургического вмешательства ей начали проводить ваЭКМО. Пациентка выжила и была выписана в удовлетворительном состоянии (9). Это публикации похожи на наш случай. Перед началом ЭКМО для стабилизации затяжного кардиогенного шока нашему пациенту тоже была установлена внутриаортальная баллонная помпа. Ввиду дальнейшего ухудшения состояния и необходимости проведения СЛР в качестве меры поддержки в ожидании хирургического вмешательства, а также для контроля ССВО и цитокинового шторма и оптимизации периоперационной гемодинамики пациенту начали проводить ваЭКМО в комбинации с экстракорпоральной очисткой крови. Хотя наш пациент в итоге скончался от септического шока после эксплантации ЭКМО, сравнение результатов ТЭЭ до и после хирургического вмешательства свидетельствовало об улучшении функционирования ПЖ. Более того, наблюдалось значительное сокращение потребности в вазопрессорах и инотропах, а также стабилизация основных показателей жизнедеятельности в течение 36 часов после начала экстракорпоральной очистки крови, комбинированной с ЭКМО.
Во всех отчетах о клинических случаях, упомянутых выше, ЭКМО применялась только как опция второй очереди после неудачной имплантации механического устройства поддержки желудочка. Может ли выбор ЭКМО при кардиогенном шоке заменить в ряду терапевтических методов первой линии установку интрааортальной баллонной помпы, чрескожного устройства поддержки желудочка и проч., подлежит обсуждению. К тому же, комбинация ЭКМО и удаления цитокинов может стать многообещающей техникой ведения пациентов с кардиогенным шоком и ССВО в ожидании операции. Более крупные исследования требуются для поддержки этого утверждения клинической практикой, особенно в связи с отсутствием на сегодняшний день рандомизированного исследования, демонстрирующего явное превосходство удаления цитокинов по сравнению с существующими методиками экстракорпоральной терапии.
Заявления
Финансовая поддержка: грантов или иного финансирования для настоящего исследования не предоставлялось.
Конфликт интересов: Ни один из авторов не имеет связанных с исследованием финансовых интересов, подлежащих раскрытию.
Ссылки
- Arnaoutakis GJ, Zhao Y, George TJ, Sciortino CM, McCarthy PM, Conte Surgical repair of ventricular septal defect after myocardial infarction: outcomes from the Society of Thoracic Surgeons National Database. Ann Thorac Surg. 2012;94(2):436-444.
- Viveiros Monteiro A, Galrinho A, Moura Branco L, Fragata J, Cruz Ferreira Multiple mechanical complications in ST-segment elevation myocardial infarction with angiographically normal coronary arteries. Rev Port Cardiol. 2015;34(3):209.e1-209.e3.
- Crenshaw BS, Granger CB, Birnbaum Y, et al; GUSTO-I (Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries) Trial Risk factors, angiographic patterns, and outcomes in patients with ventricular septal defect complicating acute myocardial infarction. Circulation. 2000;101(1): 27-32.
- Park SJ, Kim JB, Jung SH, Choo SJ, Chung CH, Lee Surgical Repair of Ventricular Septal Defect after Myocardial Infarction: A Single Center Experience during 22 Years. Korean J Thorac Cardiovasc Surg. 2013;46(6):433-438.
- Hochman JS, Buller CE, Sleeper LA, et al. Cardiogenic shock complicating acute myocardial infarction etiologies, management and outcome: a report from the SHOCK Trial Should we emergently revascularize occluded coronaries for cardiogenic shock? J Am Coll Cardiol. 2000;36(3)(Suppl A): 1063-1070.
- Kacer J, Lindovska M, Surovcik R, et al. Refractory cardiogenic shock due to extensive anterior STEMI with covered left ventricular free wall rupture treated with awake VA-ECMO and LVAD as a double bridge to heart transplantation - collaboration of three cardiac Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2015;159(4):681-687.
- Jacob S, Patel MJ, Lima B, et al. Using extracorporeal mem- brane oxygenation support preoperatively and postoperatively as a successful bridge to recovery in a patient with a large infarct-induced ventricular septal defect. Proc (Bayl Univ Med Cent). 2016;29(3):301-304. Bayl Univ Med
- Rohn V, Spacek M, Belohlavek J, Tosovsky Cardiogenic shock in patient with posterior postinfarction septal rupture successful treatment with extracorporeal membrane oxygenation (ECMO) as a ventricular assist device. J Card Surg. 2009;24(4): 435-436.
- Gregoric ID, Mesar T, Kar B, et al. Percutaneous ventricular as- sist device and extracorporeal membrane oxygenation support in a patient with postinfarction ventricular septal defect and free wall rupture. Heart Surg Forum. 2013;16(3):E150-E151.
- Shekar K, Mullany DV, Thomson B, Ziegenfuss M, Platts DG, Fraser Extracorporeal life support devices and strategies for management of acutecardiorespiratory failure in adult patients: a comprehensive review. Crit Care. 2014;18(3):219.
- Schmidt F, Jack T, Sasse M, et Awake Veno-arterial Extracorporeal Membrane Oxygenation in Pediatric Cardiogenic Shock: A Single-Center Experience. Pediatr Cardiol. 2015;36(8): 1647- 1656.
- Pang PY, Sin YK, Lim CH, et al. Outcome and survival analysis of surgical repair of post-infarction ventricular septal rupture. J Cardiothorac Surg.2013;8:44.
- Lundblad R, Abdelnoor M, Geiran OR, Svennevig JL. Surgical repair of postinfarction ventricular septal rupture: risk factors of early and late death. J Thorac Cardiovasc Surg. 2009; 137(4):862-868.
- Parsons M. Cytokine storm in the pediatric oncology patient. J Pediatr Oncol Nurs. 2010;27(5):253-258.
- Einecke G, Beutel G, Hoeper MM, Kielstein The answer is blowing in the wind: an uncommon cause for severe ARDS accompanied by circulatory insufficiency requiring extracorporeal membrane oxygenation. BMJ Case Rep. 2017 Mar 24. doi: 10.1136/bcr-2016-218079.
- Kogelmann K, Jarczak D, Scheller M, Drüner M. Hemoadsorption by CytoSorb in septic patients: a case series. Crit Care. 2017;21(1):74. Есть в переводе на сайте www.cytosorb.ru
- David S, Thamm K, Schmidt BM, Falk CS, Kielstein Effect of extracorporeal cytokine removal on vascular barrier function in a septic shock patient. JIntensive Care. 2017;5:12. Есть в переводе на сайте www.cytosorb.ru
- Bruenger F, Kizner L, Weile J, Morshuis M, Gummert First successful combination of ECMO with cytokine removal therapy in cardiogenic septic shock:a case report. Int J Artif Organs. 2015;38(2):113-116. Есть в переводе на сайте www.cytosorb.ru
- Hinz B, Jauch O, Noky T, Friesecke S, Abel P, Kaiser R. CytoSorb, a novel therapeutic approach for patients with septic shock: a case report. Int J ArtifOrgans. 2015;38(8):461-464. Есть в переводе на сайте www.cytosorb.ru
- Träger K, Jauch O, Noky T, Friesecke S, Abel P, Kaiser R. Treatment of post-cardiopulmonary bypass SIRS by hemoadsorption: a case series. Int J Artif Organs. 2016;39(3):141-146.
Публикации по теме:
- CytoSorb в кардиохирургии. Подборка публикаций
- Применение CytoSorb при гипербилирубинемии на фоне инфекционного эндокардита
- Применение CytoSorb во время кардиохирургического вмешательства с использованием искусственного кровообращения у пациентки с эндокардитом искусственного клапана
- Применение CytoSorb для сорбции апиксабана во время экстренного кардиохирургического вмешательства: клинический случай
- Применение CytoSorb во время кардиохирургического вмешательства с использованием искусственного кровообращения по поводу инфекционного эндокардита
- Влияние интраоперационной адсорбции цитокинов на клинический исход после ортотопической трансплантации сердца – обсервационное исследование

