Общая оценка результатов: После получения согласия родственников субъектам в течение 4 часов производилась гемоадсорбция с использованием гемосорбента CytoSorb. Влияние на цитокины (фактор некроза опухоли, интерлейкин [IL]-6 и IL-10) как в устройстве, так и в плазме оценивалось спустя определенное время. Целесообразность удаления цитокинов оценивалась с использованием объективных критериев.
Результаты: Объем удаленных посредством CytoSorb цитокинов варьировался от 4% до 30% и не зависел от длительности процедуры (от 1 до 4 часов). В целом, максимальный объем удаления был достигнут для IL-6, 28% (p=.006), а минимальный объем зафиксирован для фактора некроза опухоли, 8.5% (p=.13). Концентрации в плазме для IL-6 и фактора некроза опухоли, но не для IL-10, существенно снизились после первого часа терапии; средняя разница составила -13% ± 7% для IL-6 (p=.039), -23% ± 9% для фактора некроза опухоли (p=.02) и -2% ± 7% дляIL-10 (p=23). Однако концентрации плазмы во всех трех случаях повысились с течением времени и к концу вмешательства были выше исходных. Никаких отрицательных действий терапии замечено не было. Однако удаление кортизола и трийодтиронина было сходным с удалением цитокинов.
Выводы: Гемоадсорбция с целью удаления цитокинов у людей в состоянии мозговой смерти целесообразна. Оценить возможную клиническую выгоду можно посредством выполнения контролируемых исследований с участием настоящих доноров. Тем не менее, возможность удаления большого объема цитокинов и отсутствие отрицательных воздействий делают подобные тесты оправданными. (Crit Care Med 2008; 36:268–272)
Ключевые слова: донорство органов; смерть мозга; цитокины; медиаторы воспаления; интерлейкин-6; интерлейкин-10; фактор некроза опухоли; очистка крови; гемоадсорбция; сепсис; заготовка органов; трансплантация.
* См. также стр. 362.
От Лаборатории CRISMA (Clinical Research, Investigation, and Systems Modeling of Acute Illness – Клиническое обследование, изучение и системное моделирование острых заболеваний) кафедры реаниматологии Школы медицины Питтсбургского Университета, Питтсбург, Пенсильвания (JAK, RV, ME, MC) и Кафедры нейрохирургии Центра медико-санитарных дисциплин Техасского университета, Хьюстон, шт. Техас (DP, GH).
Авторы не исключают возможного столкновения интересов.
Исследование частично выполнялось на средства гранта HIDonOR (Гемоадсорбция для повышения качества донорских органов), HRSA 1 R38OT01300-01-00 от Управления здравоохранения и медицинского обслуживания Министерства здравоохранения и социальных служб США при дополнительной поддержке со стороны компаний MedaSorb Technologies, Принстон, шт. Нью-Джерси, предоставившей устройства CytoSorb; Diagnostic Products Corporation, Лос-Анджелес, шт. Калифорния, обеспечившей цитокиновые пробы и Arrow International, Рединг, шт. Пенсильвания, предоставившей катетеры для диализа.
За дополнительной информацией относительно данной статьи просьба обращаться по адресу Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
© 2007 Авторские права принадлежат Society of Critical Care Medicine и Lippincott Williams & Wilkins
DOI: 10.1097/01.CCM.0000291646.34815.BB
Последние достижения в лекарственной иммунодепрессивной терапии и хирургических методиках значительно улучшили исходы трансплантаций для пациентов с тяжелой терминальной стадией недостаточности какого-либо органа. Вследствие этого, лист ожидания аллотрансплантатов от доноров трупной ткани, самого крупного источника органов для трансплантации, уверенно растет [1]. На сегодняшний день в США ожидает органа для трансплантации столько пациентов, как никогда раньше; более 90,000 пациентов в настоящий момент зарегистрировано в системе United Network for Organ Sharing (UNOS) ( http://optn.transplant.hrsa.gov ). Повышенный спрос на органы наводит на размышления о критериях доноров, о том, что ранее казалось не слишком уместным: о так называемых донорах с расширенными критериями [2, 3].
Традиционные и расширеннные критерии позволяют распознать неблагоприятное состояние органа и предположить неудачный исход трансплантации этого органа. Нежелательными органы могут стать по причине возраста донора, данных о его росте и весе или из-за несовпадения пола, а также при наличии в истории болезни упоминаний о курении или таких сопутствующих заболеваниях, как заболевания коронарных или периферических сосудов, диабеты или почечная недостаточность. Также подвергнуть риску ухудшения работы органа или неудачи при трансплантации потенциально годный для трансплантации орган могут гормональные, сердечно-сосудистые или эндокринные изменения, произошедшие в процессе смерти мозга [4, 5].
Смерть мозга обычно приводит к серьезным нарушениям регионарной перфузии [6] вследствие симпатического влияния с последующим автономным упадком жизнедеятельности [8], а также влечет за собой целый ряд иммунологических изменений [9, 10]. Из всех многочисленных механизмов смерть мозга связывается с массовым выбросом провоспалительных цитокинов, которые определяются как в крови [10-12], так и в органах, предназначенных для трансплантации [13, 14]. Более того, этот повышенный воспалительный ответ ассоциируется со снижением функции аллотрансплантата, в особенности сердца [15-18]. Пародоксально, но замещение гормонов, противодействующих провоспалительному влиянию цитокинов, в том числе кортикостероидов [19], трийодтиронина [20-22] и аргинина-вазопрессина [23] может способствовать поддержанию работы сердца донора после смерти мозга. Однако эти медикаменты оказывают и другое потенциально важное воздействие на работу органов, нарушая казуальную связь между антагонизмом цитокинов и исходом. Иммуномодулирующие лекарства обладают также целым рядом побочных эффектов и могут таким образом повреждать целевые органы.
В отличие от лекарств, очистка крови с использованием гемофильтрации и гемоадсорбции может быть идеальным методом формирования иммунного ответа у доноров с мозговой смертью [24]. Сначала мы протестировали CytoSorb, прибор для удаления цитокинов методом гемоадсорбции, in vitro [25] и на животных с сепсисом [26]. В результате было удалено значительное количество цитокинов. Мы провели настоящее пилотное исследование с целью оценить целесообразность и эффективность использования прибора CytoSorb у доноров с мозговой смертью. Учитывая предварительный характер нашего исследования, мы выбрали в качестве участников субъектов с мозговой смертью, признанных непригодными для донорства органов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Места проведения и участники: Мы распределили субъектов исследования по двум местам исследования: в Медицинский центр Питтсбургского университета, Питтсбург, шт. Пенсильвания и в Мемориальный госпиталь Херманна, Хьюстон, Техас. Критерии включения в исследование были следующими: официальное заключение о смерти мозга, выполненное согласно утвержденной в больнице процедуре и решение местной организацией трансплантационной координации о признании субъекта непригодным для донорства органов. Критериями исключения из исследования были возраст менее 16 лет, невозможность получить информирование согласие официальных представителей субъекта, включение в экспериментальные протоколы, при которых цитокины являются терапевтической мишенью (например, антитела анти-TNF), получение химиотерапии или диагностирование любого заболевания (например, СПИД), провоцирующего лейкопению (число белых кровяных телец <2), получение антилейкоцитарных препаратов. В исследовании принимали участие следующие организации трансплантационной координации: Center for Organ Recovery and Education (CORE), Питтсбург, шт. Пенсильвания и Life-Gift, Хьюстон, шт. Техас. Мы получили разрешение на исследование от Питтсбургского Комитета по надзору за исследованиями с участием умерших (Pittsburgh Committee for Oversight of Research Involving the Dead (CORID)) и от Центра медико-санитарных дисциплин Техасского университета при Хьюстонском Комитете по защите человека (the University of Texas Health Science Center at Houston Committee for the Protection of Human Subjects). До включения в исследование от родственников всех участников были получены письменные информированные согласия.
Процедуры исследования: После завершения отбора участников, мы случайным образом распределили их на группы, в одной из которых доноры получали 4 часа гемоадсорбции с использованием 300 мл картриджа CytoSorb, а в другой с использованием 500 мл картриджа CytoSorb. Активный компонент CytoSorb представляет собой адсорбирующие гранулы полимера, состоящие из пористых полимеризованных дивинилбензолов. Гранулы имеют поры такого размера, чтобы удалять цитокины. Полимерные гранулы заключены в поликарбонатный контейнер, обычно используемый в имеющихся в продаже диализаторах. При рандомизации использовались последовательно пронумерованные, заклеенные конверты. Гемоадсорбция проводилась в открытой, неослепленной форме. Исходные и последующие клинические данные мы собирали посредством прикроватных измерений и выписок из медицинских карт. Мы хранили данные в форме медицинских карт, которые во избежание ошибок заносились в базу двумя сотрудниками. Мы забирали кровь для цитокиновой пробы сразу после отбора участников, а также каждый час во время терапии. В конце 1-го и 4-го часа мы также взяли пробы крови из входного и выходного отверстий устройства CytoSorb. Все научные сотрудники и персонал лаборатории, причастные к сбору данных и проб, проходили соответствующее обучение и проверки на протяжении всего исследования. Отбор субъектов для участия в исследовании проводился с июля 2004 г. по сентябрь 2005 г.
Процедура гемоадсорбции: Прикроватный картридж CytoSorb был заправлен 2 литрами 0,9% солевого раствора. Сосудистый доступ обеспечивался посредством стандартного диализного катетера (Arrow International, Reading, PA), установленного в бедренную вену и подключенного к устройству CytoSorb посредством стандартных диализных катетеров. Кровь перекачивалась через устройство с помощью кровяного насоса BM-11 (Baxter Healthcare, Deerfield, IL). Начальная скорость потока была установлена на уровне 150 мл/мин. Скорость кровотока была устанавлена на уровне 120 и 180 мл/мин, в зависимости от проведения процедур доступа. Для антикоагуляции выполнялись инфузии нефракционированного гепарина, подобранные так, чтобы время свертывания крови составляло от 141 до 180 секунд.
Цитокиновые пробы: В качестве маркеров провоспалительного цитокинового ответа мы измеряли фактор некроза опухоли (TNF) и интерлейкин (IL)-6, а в качестве маркеров антивоспалительного цитокинового ответа – IL-10. Пробы крови забирались до начала исследования и далее каждый час в течение 4 часов. В конце 1-го и 4-го часа мы также взяли пробы крови из входного и выходного отверстий устройства CytoSorb. Образцы крови помещались в апирогенные пробирки с гепарином или пробирки без консерванта. Плазма отделялась с помощью центрифугирования и замораживалась при температуре -80°С. Измерения фактора некроза опухоли (TNF), IL-6 и IL-10 выполнялись с помощью хемилюминесцентного иммунологического анализа с использованием автоматического анализатора (IMMULITE, Diagnostic Products, Los Angeles, CA), причем образцы размораживались непосредственно перед измерением.
Пробы комплемента: Мы измеряли фракции комплемента C3a-desArg и SC5b-9. Все пробы собирались в апирогенные двунатриевые или дикалиевые пробирки EDTA пробирки, которые клали на лед и обрабатывали в течение 30 минут. Плазма отделялась в 6 стерильных криопробирок и замораживалась при -80°С. Для проб комплемента использовались имеющиеся в продаже наборы для ферментного иммунологического анализа (EIA) (Quidel, San Diego, CA).
Меры безопасности: Возможные осложнения гемоадсорбции оценивались с помощью серии измерений компонентов крови, которые по своему молекулярному размеру могли быть удалены посредством устройства CytoSorb. Сюда относятся трийодтиронин и кортизол (измерялись в образцах крови до и после прохождения через картридж), а также концентрации глюкозы, альбумины, тромбоцитов, лейкоцитов и гемоглобина до и после гемоадсорбции. Мы измеряли комплемент (C3a-desArg и SC5b-9) в time points 1, 2, 3 и 7 для оценки биосовместимости. Клиническая переносимость оценивалась посредством определения сердечнососудистой и легочной функций (среднее артериальное давление, потребность в вазопрессорах и соотношение PaO2/ FIO2).
Расчеты, оценки и статистический анализ: Мы рассчитали производительность в отношении удаления цитокинов путем сравнения концентраций цитокинов до и после картриджа (пробы из входного и выходного отверстий) и выразили результат в виде процента от объема до картриджа. Концентрации всех измерявшихся субстанций выражались в виде процента от исходных (до гемоадсорбции) концентраций. Для двух субъектов не удалось установить исходную концентрацию IL-10, в связи с чем, они были исключены из анализа производительности в отношении удаления, однако спустя время они были включены в сравнения, а за исходную концентрацию было принято значение по нижней границеобнаружения (5 пг/мл).
Статистические анализы выполнялись при помощи программного обеспечения MedCalc (Мариакерке, Бельгия). Мы сравнивали рассчитали производительность в отношении удаления у парных образцов при помощи теста Вилкоксона (Wilcoxon’s test) и принимали значение альфа за p < .05. Средние значения указывались с учетом ± стандартной погрешности. Учитывая, что в исследовании было включено небольшое количество субъектов, мы даже не предпринимали попытки провести сравнение 300 мл и 500 мл картриджей с какой-либо претензией на достоверность. Тем не менее, там, где это очевидно, мы описываем различия.
РЕЗУЛЬТАТЫ
Включение в исследование и рандомизация: Несмотря на то, что мы планировали исследовать 24 субъекта за 12 месяцев, нам удалось найти только 8 субъектов за 14 месяцев. Столь маленькое число участников исследования не было следствием отказа от информированного согласия. На самом деле, лишь два дополнительных пациента были отклонены на этапе допуска к участию в исследовании по причине несоответствия критериям. Зато значительно меньшее, чем ожидалось, число субъектов, у которых была диагностирована мозговая смерть, было признано непригодным для донорства органов. Это несоответствие между предполагаемым и реальным набором участников, вероятно, было следствием активного использования «расширенных критериев донора» [2, 3] и клинической практики, при которой уход за пациентов прекращается до смерти мозга после признания субъекта непригодным или неподходящим для донорства. Восемь субъектов, включенных в исследование, были распределены следующим образом: трое в группу с картриджем 500 мл, пятеро в группу с картриджем 300 мл.
Целесообразность: Гемоадсорбция у данных субъектов с мозговой смертью оказалась целесообразной и безопасной. Демографический, клинический и лабораторные данные до и после проведения процедур отражены в Таблице 1. Один диализный катетер слипся во время процедуры, однако других сбоев при проведении лечения не происходило. За время курса процедур существенно снизилось количество тромбоцитов: 36.6% в группе с 500 мл картриджем и 21% в группе с 300 мл картриджем. Хотя явных изменений в количестве тромбоцитов при измерении в устройстве через час и через 4 часа после начала процедуры отмечено не было, также не было зафиксировано кровотечения или снижения концентрации гемоглобина. Число белых кровяных телец, уровень глюкозы и концентрация альбумина не изменились. Результаты активации комплемента отражены в Таблице 2; никаких признаков активации комплемента выявлено не было.
Таблица 1. Физиологические данные до и после процедуры
| Переменные | До процедуры | После процедуры | Значение p |
| ЧСС, ударов/мин | 91.4 ± 16.7 | 92.8 ± 27.1 | >.05 |
| САД, мм.рт.ст. | 77.6 ± 9.3 | 79.3 ± 12.8 | >.05 |
| Темп., °С | 36.4 ± 1.3 | 35.5 ± 1 | >.05 |
| FIO2,% | 70 ± 30 | 70 ± 20 | >.05 |
| PEEP, см H2O | 5.9 ± 2.7 | 7.1 ± 3.2 | >.05 |
| Доза Норэпинефрина, µg кг-1 мин-1 | 0.4 ± 0.3 | 0.6 ± 0.5 | >.05 |
| PaO2, мм.рт.ст. | 188.33 ± 160.2 | 161 ± 102.8 | >.05 |
| PaO2/ FIO2 | 258 ± 142.5 | 238.8 ± 109.4 | >.05 |
| Гемоглобин, г/дл | 9.9 ± 1.6 | 12.5 ± 2.6 | >.05 |
| Гематокрит, % | 28.9 ± 4.4 | 37.3 ± 8.8 | >.05 |
| Тромбоциты Х 10Е + 9/L | 156/9 ± 50.2 | 168 ± 11.3 | >.05 |
| Лейкоциты Х 10Е + 9/L | 10 ± 4.6 | 10.2 ± 6.2 | >.05 |
| Альбумин, г/дл | 2.4 ± 0.8 | 2.9 ± 0.6 | >.05 |
| Глюкоза, мг/дл | 128.5 ± 64.8 | 125.4 ± 59 | >.05 |
| Натрий, мэкв/л | 147 ± 5.9 | 145.1 ± 6.6 | >.05 |
| Калий, мэкв/л, | 3.4 ± .5 | 3.3 ± .4 | >.05 |
ЧСС – частота сердечных сокращений; САД – среднее артериальное давление; PEEP - положительное концевое давление выдоха.
Таблица 2 Изучение активации комплемента
| Время, мин. | 0 | 15 | 45 | 240 |
| C3a, нг/мл | 654 ± 107 | 533 ± 118 | 564 ± 99 | 258 ± 49 |
| C5b-9, нг/мл | 513 ± 85 | 552 ± 75 | 596 ± 71 | 529 ± 55 |
Таблица 3 Производительность в отношении удаления цитокинов посредством прибора
| TNF | IL-6 | IL-10 | Кортизол | |
| Время 1 | ||||
| До | 11.4 | 374.4 | 22.6 | 8.2 |
| После | 11.0 | 261.4 | 19.0 | 4.2 |
| % изменения | -3.9 | -30.2 | -15.8 | -48.8 |
| Время 4 | ||||
| До | 18.6 | 1708.0 | 50.8 | 6.2 |
| После | 16.5 | 1237.6 | 46.9 | 5.2 |
| % изменения | -11.3 | -27.5 | -7.7 | -16.1 |
| Общие | ||||
| До | 15.0 | 1041.2 | 40.2 | 7.2 |
| После | 13.7 | 749.5 | 36.4 | 4.7 |
| % изменения | -8.5 | -28 | -9.4 | -34.7 |
| Значение pa | .13 | .006 | .039 | .004 |
TNF - фактор некроза опухоли; IL – интерлейкин; До – результаты анализа образцов, взятых из входного отверстия прибора; После - результаты анализа образцов, взятых из выходного отверстия прибора. а – значения p (тест Вилкоксона, Wilcoxon’s test), применяемые для сопоставления концентраций в плазме для проб, взятых из входного (До) и выходного (После) отверстий прибора, учитывая одновременно Время 1 и Время 4.
Удаление цитокинов: Результаты удаления цитокинов оценивались посредством измерения концентраций медиаторов в крови до и после картриджа, а также измерение концентраций медиаторов спустя время. Концентрации, полученные в результате измерения до и после картриджа через 1 и 4 часа после начала измерения отражены в Таблице 3. Объем удаленных цитокинов варьировался от 4% до 30% между концами прибора, а интенсивность удаления при измерении через 1 час и через 4 часа существенно не отличалась. В целом, объем удаления был максимальным для IL-6 (28%, p= .006) и минимальным для фактора некроза опухоли (8,5%, p= .13).
После часа терапии концентрации IL-6 и фактора некроза опухоли в плазме существенно понизились, что нельзя сказать об IL-10 (Рис.1). Средняя разница составила -13% ±7% для IL-6 (p = .039), -23% ± 9% для фактора некроза опухоли (p = .02) и -2% ± 7% для IL-10 (p = .23). Однако спустя некоторое время уровень всех трех цитокинов возрос и к концу процедуры гемоадсорбции концентрации в плазме были выше исходных.
Кортизол и Трийодтиронин: Также мы измеряли сывороточный кортизол и трийодтиронин до и после картриджа. Уровень трийодтиронина были ниже уровня определения для всех субъектов, кроме одного. Но для этого субъекта объем удаления составил 20%. Объем удаления кортизола указан в Таблице 3. Удаление было максимальным через час (время 1) (48,8%) по сравнению с измерениями через 4 часа (время 4) (16,1%).
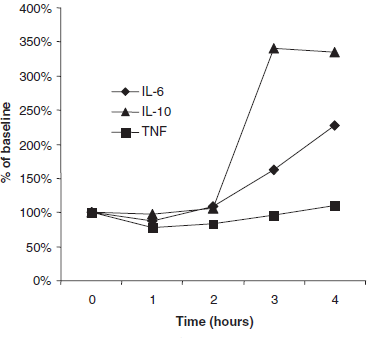
Рисунок 1 Показаны средние уровни интерлейкина (IL)-6, IL-10 и фактора некроза опухоли (TNF) в плазме спустя время в сравнении с исходными концентрациями.
% of baseline - % от исходных концентраций; Time (hours) – время (часы).
ОБСУЖДЕНИЕ
В настоящее время существует острый дисбаланс между органами, доступными для пересадки и потребностью в них. В 2006 году около 7400 доноров предоставили более 26000 органов или около 3,5 органов каждый. Благодаря сохранению органов хотя бы из расчета 0,5 органа на донора можно было бы повысить число доступных для пересадки органов на 14%. Также можно было бы восстановить некоторое количество дополнительных органов от доноров, которые в иных условиях могли бы быть признанными непригодными для донорства вследствие тяжелого шока или дисфункции органов. В конечном итоге, поскольку банк доноров органов расширяется за счет включения в него менее идеальных доноров, технологии, позволяющие сократить дисфункцию органов будут все более востребованы и важны.
В ситуации, когда циркулирующие медиаторы воспаления способствуют дисфункции органа как в процессе мозговой смерти, так и после нее, и могут сделать орган неподходящим для трансплантации, гемоадсорбция могла бы стать интересной терапевтической возможностью. Наше исследование показало, что короткий курс гемоадсорбции, проведенный субъекту с мозговой смертью целесообразен и позволяет удалить цитокины.
Учитывая неконтролируемый дизайн данного исследования целесообразности можно лишь строить предположения относительно клинической эффективности с точки зрения снижения уровней воспалительных цитокинов в крови и тканях. Однако стоит отметить значительный объем удаленных цитокинов IL-6 и фактора некроза опухоли. Хотя уровни фактора некроза опухоли и IL-6 повысились через час после начала процедуры (что означает продолжение их выработки), скорость роста обоих цитокинов была ниже, чем ожидалось, исходя из опыта наблюдений за субъектами, не получавшими курса гемоадсорбции [10-12]. Впрочем, эти опубликованные исследования могли проводиться в условиях, существенно отличавшихся от описанных в нашей работе, что делает прямое сравнение невозможным. Серьезность повреждения или стадия мозговой смерти могла оказывать влияние на уровни цитокинов, из чего следует, что для изучения эффективности необходимо проведение испытаний на реальных донорах. Важно отметить, что не было зафиксировано никаких признаков сатурации, поскольку устройство, по-видимому, работало одинаково хорошо через 1 и 4 часа после начала процедуры (время 1 и 4 соответственно, Таблица 3). Хотя у этих субъектов спустя время мы не заметили признаков улучшения гемодинамики или работы органов (Таблица 1). Некоторые исследования описывают уровни IL-10 в плазме людей с мозговой смертью. Согласно нашим данным уровень активизации этих противовоспалительных цитокинов весьма низок, причем гемоадсорбция мало поповлияла на эти низкие уровни.
Связь между физиологическими изменениями, происходящими в процессе мозговой смерти, и повреждением потенциально годных для трансплантации органов кажется весьма серьезной. Однако индивидуальные особенности и относительная важность по отношению к недостаточности органов не позволяет хорошо исследовать такие факторы, как циркулирующие цитокины, повышение уровня катехоламинов, альтерации эндокринных гормонов и изменения сосудистого тонуса [6, 27-31]. Результаты экспериментов над животными и наблюдений за людьми показали, что быстрое повышение внутричерепного давления регулирует посредством роста уровень различных, производных от лимфоцитов и макрофагов, цитокинов [11]. Кроме того, повышенный выброс провоспалительных цитокинов, зафиксированный у животных с мозговой смертью [13], а также отдельные повышения IL-6 в плазме были отмечены у доноров с мозговой смертью [12]. Stangl и соавторы [10] приводят данные о значительном повышении уровней TNF, IL-6, IL-8 и рецептора IL-2 в крови доноров с мозговой смертью в сравнении с жизнеспособными донорами. В более позднем исследовании Plenz и соавторы [14] продемонстрировали выраженную активацию системы рецепторов IL-6 / IL-6 в сердцах доноров в сравнении с результатами биопсии миокарда, взятой у контрольных пациентов. Таким образом, у доноров с мозговой смертью как уровень IL-6 в плазме, так и восприимчивость к IL-6 повышаются одновременно (вследствие усиления работы системы рецепторов IL-6). Следовательно, правдоподобно, что снижение работоспособности и жизнеспособности органов-эксплантатов от доноров с мозговой смертью связано отчасти с воспалительным ответом в процессе развития и после мозговой смерти [14-18]. И наоборот, цитокины могут быть скорее только маркёрами повреждения органа, а не медиаторами. В этом случае очистка крови может служить только средством удаления цитокинов, но не окажет влияния на работу органов.
Недавно мы продемонстрировали, что гемоадсорбция с использованием устройства CytoSorb поволяет эффективно удалять разнообразные медиаторы воспаления и повышает кратковременную жизнеспособность трансплантата у подопытных животных с сепсисом [26]. Наши результаты, полученные в настоящем исследовании, позволяют предположить такое же влияние на цитокины в плазме у людей с мозговой смертью. Однако в целом измерения в концентрациях цитокинов в плазме были незначительными и неизвестно, будет ли подобное воздействие достаточным для улучшения клинических исходов, например, таких, как кратковременная жизнеспособность органа. Наши результаты показывают, что подобная процедура целесообразна, и в сочетании с небольшим количеством усилий, прилагаемых для достижения результата, не было обнаружено никаких негативных последствий. Эти результаты формируют теоретическую базу для проведения дополнительных исследований с участием субъектов после мозговой смерти, возможно, действующих доноров. Дальнейшие исследования позволят изучить большее число содержащихся в плазме необходимых компонентов и соединений, чтобы понять, не удаляются ли они в чрезмерном количестве в процессе гемоадсорбции, и нет ли необходимости в восполнении этих составляющих перед изъятием органа. Например, удаление трийодтиронина и кортизола в существующей практике может потребовать повышенного восполнения. Также внимание будет уделено физиологическим маркёрам работоспособности таких органов, как легкие, сердце, печень и почки. Обнаруженное в результате исследование снижение числа тромбоцитов нельзя приписать исключительно гемоадсорбции; в настоящем исследовании концентрации тромбоцитов в группах с разными картриджами не отличались и не зависели от клинического кровотечения. Наше исследование – одно из немногих, в которых субъектами наблюдения являлись пациенты с мозговой смертью, поэтому небольшое отступление на тему целесообразности, этики и уместности изучения этой исследуемой совокупности кажется вполне оправданным. Во-первых, включение упомянутых субъектов с мозговой смертью в исследование не стало дополнительным бременем для их семей. Доля отказавшихся оказалась удивительно небольшой, и многие семьи выказали заинтересованность в подобной возможности, даже если они были против реального донорства. Однако количество субъектов, которые подошли по всем параметрам для нашего исследования, оказалось меньше, чем ожидалось. Формально диагностирование мозговой смерти не проводится пациентам, признанным непригодными для донорства органов, следовательно, возможность участия в нашем исследовании была предложена небольшому числу семей. Наконец, субъекты с мозговой смертью, признанные непригодными для донорства органов, могут быть не репрезентативными в отношении настоящих доноров, таким образом, возможность обобщения результатов, полученных нами при изучении данной группы пациентов, весьма ограничена. С точки зрения оценки целесообразности это могло и не представлять проблемы. Однако этот контингент мог быть менее подходящим при анализе эффективности процедур. Это затрагивает потенциальную проблему, связанную с тем, что ранние интервенционные исследования с участием настоящих доноров были смелыми в материально-техническом плане и наводили на оригинальные этические размышления.
ЗАКЛЮЧЕНИЕ
Гемоадсорбция после мозговой смерти позволяет удалять цитокины из крови. Значительная пропускная способность при удалении цитокинов может быть серьезным преимуществом для сокращения воспалительного ответа, вызванного с мозговой смертью. Оценка клинической эффективности этой процедуры с точки зрения повышения работоспособности органа потребует проведения контролируемых исследований с участием настоящих доноров.
БИБЛИОГРАФИЯ
1. United Network for Organ Sharing: 1996 Annual Report of the US Scientific Registry of Transplant Recipients and the Organ Procurement and Transplantation Network. Washington, DC, US Department of Health and Human Services, 1996
2. Kauffman HM, McBride MA, Rosendale JD, et al: Trends in organ donation, recovery and disposition: UNOS data for 1988 –1996. Transplant Proc 1997; 29:3303–3304
3. Mandal AK, Kalligonis AN, Ratner LE: Expanded criteria donors: Attempts to increase the renal transplant donor pool. Adv Ren Replace Ther 2000; 7:117–130
4. Busson M, Benoit G, N’Doye P, et al: Analysis of cadaver donor criteria on the kidney transplant survival rate in 5,129 transplantations. J Urol 1995; 154:356–360
5. Tullius SG, Nieminen M, Bechstein WO, et al: Contribution of early acute rejection episodes to chronic rejection in a rat kidney retransplantation model. Kidney Int 1998; 53:465–472
6. Pratschke J, Wilhelm MJ, Kusaka M, et al: Brain death and its influence on donor organ quality and outcome after transplantation. Transplantation 1999; 67:343–348
7. Powner DJ, Hendrich A, Nyhuis A, et al: Changes in serum catecholamine levels in patients who are brain dead. J Heart Lung Transplant 1992; 11:1046–1053
8. Gramm HJ, Zimmermann J, Meinhold H, et al: Hemodynamic responses to noxious stimuli in brain-dead organ donors. Intensive Care Med 1992; 18:493–495
9. Pratschke J, Wilhelm MJ, Kusaka M, et al: Activation of proinflammatory genes in somatic organs as a consequence of brain death. Transplant Proc 1999; 31:1003–1005
10. Stangl M, Zerkaulen T, Theodorakis J, et al: Influence of brain death on cytokine release in organ donors and renal transplants. Transplant Proc 2001; 33:1284–1285
11. Takada M, Nadeau KC, Hancock WW, et al: Effects of explosive brain death on cytokine activation of peripheral organs in the rat. Transplantation 1998; 65:1533–1542
12. Lopau K, Mark J, Schramm L, et al: Hormonal changes in brain death and immune activation in the donor. Transpl Int 2000; 13(Suppl 1):S282–S285
13. Wilhelm MJ, Pratschke J, Beato F, et al: Activation of the heart by donor brain death accelerates acute rejection after transplantation. Circulation 2000; 102:2426–2433
14. Plenz G, Eschert H, Erren M, et al: The interleukin-6/interleukin-6-receptor system is activated in donor hearts. J Am Coll Cardiol 2002; 39:1508–1512
15. Birks EJ, Burton PB, Owen V, et al: Elevated tumor necrosis factor-alpha and interleukin-6 in myocardium and serum of malfunctioning donor hearts. Circulation 2000; 102: 352–358
16. Deng MC, Erren M, Kammerling L, et al: The relation of interleukin-6, tumor necrosis factor-alpha, IL-2, and IL-2 receptor levels to cellular rejection, allograft dysfunction, and clinical events early after cardiac transplantation. Transplantation 1995; 60:1118–1124
17. Kirklin JK, McGiffin DC: Control of the inflammatory response in extended myocardial preservation of the donor heart. Ann Thorac Surg 1999; 68:1978–1982
18. Birks EJ, Owen VJ, Burton PB, et al: Tumor necrosis factor-alpha is expressed in donor heart and predicts right ventricular failure after human heart transplantation. Circulation 2000; 102:326–331
19. Pratschke J, Wilhelm MJ, Kusaka M, et al: Accelerated rejection of renal allografts from brain-dead donors. Ann Surg 2000; 232: 263–271
20. Novitzky D, Cooper DK, Reichart B: The value of hormonal therapy in improving organ viability in the transplant donor. Transplant Proc 1987; 19:2037–2038
21. Novitzky D, Cooper DK, Reichart B: Hemodynamic and metabolic responses to hormonal therapy in brain-dead potential organ donors. Transplantation 1987; 43: 852– 854
22. Novitzky D, Cooper DK, Chaffin JS, et al: Improved cardiac allograft function following triiodothyronine therapy to both donor and recipient. Transplantation 1990; 49: 311–316
23. Pennefather SH, Bullock RE, Mantle D, et al: Use of low dose arginine vasopressin to support brain-dead organ donors. Transplantation 1995; 59:58–62
24. Venkataraman R, Song M, Lynas R, et al: Hemoadsorption to improve organ recovery from brain-dead organ donors: A novel therapy for a novel indication • Blood Purif 2004; 22:143–149
25. Song M, Winchester J, Albright RL, et al: Cytokine removal with a novel adsorbent polymer. Blood Purif 2004; 22:428–434
26. Kellum JA, Song M, Venkataraman R: Hemoadsorption removes tumor necrosis factor, interleukin-6, and interleukin-10, reduces nuclear factor-kB DNA binding, and improves short-term survival in lethal endotoxemia. Crit Care Med 2004; 32: 801– 805
27. Cecka JM: Outcome statistics of renal transplants with an emphasis on long-term survival. Clin Transplant 1994; 8:324–327
28. Terasaki PI, Cecka JM, Gjertson DW, et al: High survival rates of kidney transplants from spousal and living unrelated donors. N Engl J Med 1995; 333:333–336
29. Cecka M: Clinical outcome of renal transplantation: Factors influencing patient and graft survival. Surg Clin North Am 1998; 78:133–148
30. Hariharan S, Johnson CP, Bresnahan BA, et al: Improved graft survival after renal transplantation in the United States, 1988 to 1996. N Engl J Med 2000; 342:605–612
31. Bartlett RH: Vitalin: The rationale for a hypothetical hormone. J Am Coll Surg 2004; 199:286–292