Ключевые слова
Холестаз, печеночная недостаточность, гемоперфузия, гемоадсорбция, прурит, экстракорпоральный
Введение
(Cytosorbents, Monmouth Junction, USA) – это адсорбционная колонка, содержащая высокопористые биосовместимые горошины адсорбента, поглощающие субстанции молекулярной массой менее 55 кДа.(1) Изначально CytoSorb позиционировался как средство адсорбции цитокинов при сепсисе (2,3) (информационная справка Британского Национального института охраны здоровья и совершенствования медицинской помощи MIB87: https://www.nice.org.uk/advice/mib87/) и других воспалительных синдромах, например, при панкреатите и ожогах. Текущие исследования выявляют его место в контроле воспалительной реакции в целом ряде областей медицины, о чем свидетельствуют многочисленные данные, опубликованные в международном независимом реестре.(5) Наблюдения показывают, что уровень концентрации билирубина в плазме крови заметно снижается во время применения CytoSorb, - ранее мы пытались использовать для этого сложную систему для high-flux гемофильтрации.(6) Наш опыт работы с адсорбером CytoSorb при сепсисе, публикации других центров и желание найти более простую систему для удаления токсинов печени (7,8) натолкнули нас на мысль оценить возможности адсорбера, касающиеся поддержки функции печени на фоне медикаментозного холестаза и острого алкогольного гепатита. Мы считаем подобные заболевания в некотором роде моделями, так как спонтанное восстановление функции печени при них стандартно ожидаемо через несколько месяцев, однако, симптоматические проявления у подобных пациентов могут быть крайне тяжелыми (прурит, недомогание, анорексия), а осложнения (тяжелая желтуха, шок и энцефалопатия) зачастую не удается взять под контроль стандартными средствами.
CytoSorb используют в контуре насосов крови: в ОРИТ это, чаще всего, аппараты для продленной вено-венозной гемодиафильтрации, однако, он совместим и с аппаратами для экстракорпоральной мембранной оксигенации и искусственного кровообращения. Токсины печени, которые аккумулируются при нарушении функции печени (билирубин, желчные кислоты, меркаптаны, фенолы и нонапептиды), практически никак не выводятся при продленной ЗПТ, поскольку они представляют собой жирорастворимые связанные с белком субстанции.
Клинический случай 1
Пациент: мужчина, 51 год. До поступления: желтуха общей продолжительностью 2 недели, анорексия, потеря веса, тошнота, темная моча, кал серого цвета, прурит. Мужчина признался, что на протяжении 10 недель употреблял анаболические стероиды в спортзале для того, чтобы увеличить мышечную массу. При первой явке в поликлинику Royal Derby Hospital концентрация билирубина в крови 55 мкмоль/л, щелочная фосфатаза 272 Ед/л, АЛТ 142 Ед/л. 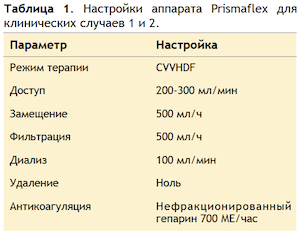 За месяц амбулаторного наблюдения симптомы прогрессировали, мужчину госпитализировали в Royal Derby Hospital с тяжелым фармакологически индуцированным холестазом, спутанностью сознания, гепатической энцефалопатией 2-3 стадии и порхающим тремором. Билирубин 254 мкмоль/л. Биопсия печени подтвердила фармакологическое повреждение печени и холестатический гепатит. За следующий месяц в больнице концентрация билирубина выросла до 538 мкмоль/л. К этому моменту потеря веса составила около 30 кг, прурит достиг такой степени тяжести, что появились шрамы на коже, развилась бессонница и депрессивный синдром с мыслями о самоубийстве. Симтоматическая терапия (цитиризин, циклизин, мометазон-крем, хлорфенамин, ондансетрон, зопиклон, темазепам, лоратадин, колестирамин, рифампицин, налтрексон, инфузии налоксона) не дала результатов.
За месяц амбулаторного наблюдения симптомы прогрессировали, мужчину госпитализировали в Royal Derby Hospital с тяжелым фармакологически индуцированным холестазом, спутанностью сознания, гепатической энцефалопатией 2-3 стадии и порхающим тремором. Билирубин 254 мкмоль/л. Биопсия печени подтвердила фармакологическое повреждение печени и холестатический гепатит. За следующий месяц в больнице концентрация билирубина выросла до 538 мкмоль/л. К этому моменту потеря веса составила около 30 кг, прурит достиг такой степени тяжести, что появились шрамы на коже, развилась бессонница и депрессивный синдром с мыслями о самоубийстве. Симтоматическая терапия (цитиризин, циклизин, мометазон-крем, хлорфенамин, ондансетрон, зопиклон, темазепам, лоратадин, колестирамин, рифампицин, налтрексон, инфузии налоксона) не дала результатов.
Пациента перевели в ОРИТ для того, чтобы иметь возможность попробовать терапию CytoSorb в качестве «толчка» к восстановлению эндогенной функции печени. Пациент дал информированное согласие на проведение процедуры.
CytoSorb установили в контур аппарата Prismaflex™ (Baxter, США), как показано на рис. 1(а). Аппарат работал в режиме продленной вено-венозной гемодиафильтрации (CVVHDF). Фото 1 (b) иллюстрирует изменение цвета колонки после адсорбции билирубина и желчных кислот. Параметры потока представлены в Таблице 1. Скорость диафильтрации низкая в связи с тем, что поддержка функции почек не являлась нашей основной задачей. 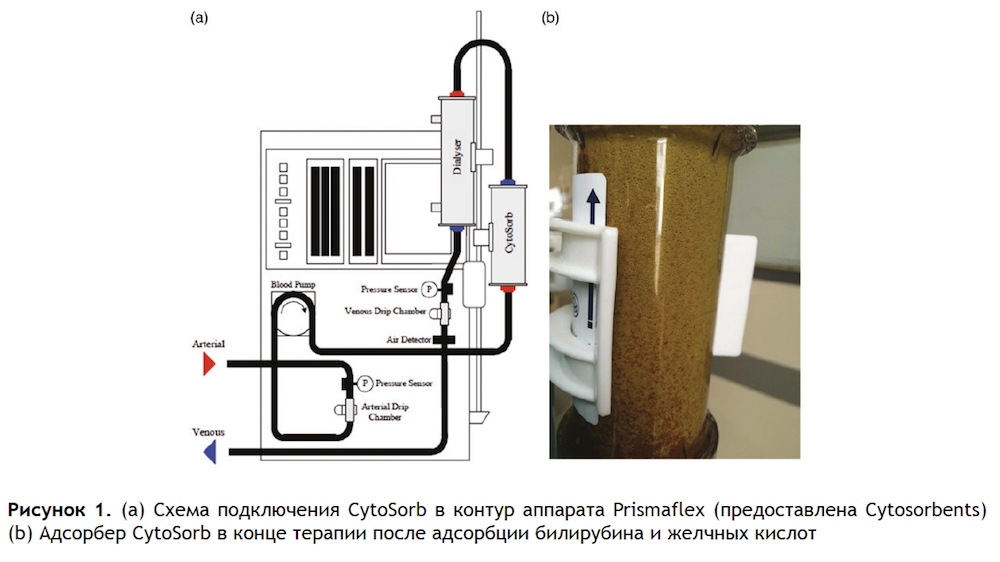
 Продолжительность терапии CytoSorb составила 41 час в течение 52 часов: сеанс 4 часа, затем перерыв 4 часа из-за перегиба магистрали и тромбирования контура, затем новый сеанс длительностью 37 часов.
Продолжительность терапии CytoSorb составила 41 час в течение 52 часов: сеанс 4 часа, затем перерыв 4 часа из-за перегиба магистрали и тромбирования контура, затем новый сеанс длительностью 37 часов.
Лабораторные данные приведены в Таблице 2.
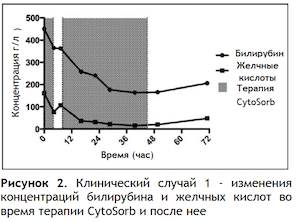
Рисунок 2 иллюстрирует изменения концентраций билирубина и желчных кислот во время терапии CytoSorb и после нее; на Рисунке 3 отображены изменения концентраций белков.
Самые низкие уровни концентрации билирубина (164 мкмоль/л) и желчных кислот (16 мкмоль/л) зарегистрированы на 2-е сутки во время перевода пациента из ОРИТ.
Через 24 часа после завершения терапии CytoSorb пациент уведомил об улучшениях состояния – регрессе прурита, тошноты и бессонницы.
После окончания терапии CytoSorb эти симптомы вернулись, однако, с гораздо более низкой интенсивностью, чем до терапии CytoSorb.
За последующие 7 суток концентрация билирубина возросла до 228 мкмоль/л, а желчных кислот - до 87 мкмоль/л. 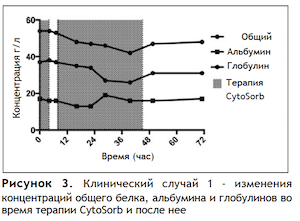 При этом спустя 5 недель концентрации маркеров холестаза в анализах крови изменялись в направлении нормы, у пациента улучшился аппетит, он набрал 6 кг веса.
При этом спустя 5 недель концентрации маркеров холестаза в анализах крови изменялись в направлении нормы, у пациента улучшился аппетит, он набрал 6 кг веса.
Концентрация желчных кислот замерла на одной отметке, назначен гидроксизин.
Прурит регрессировал далее.
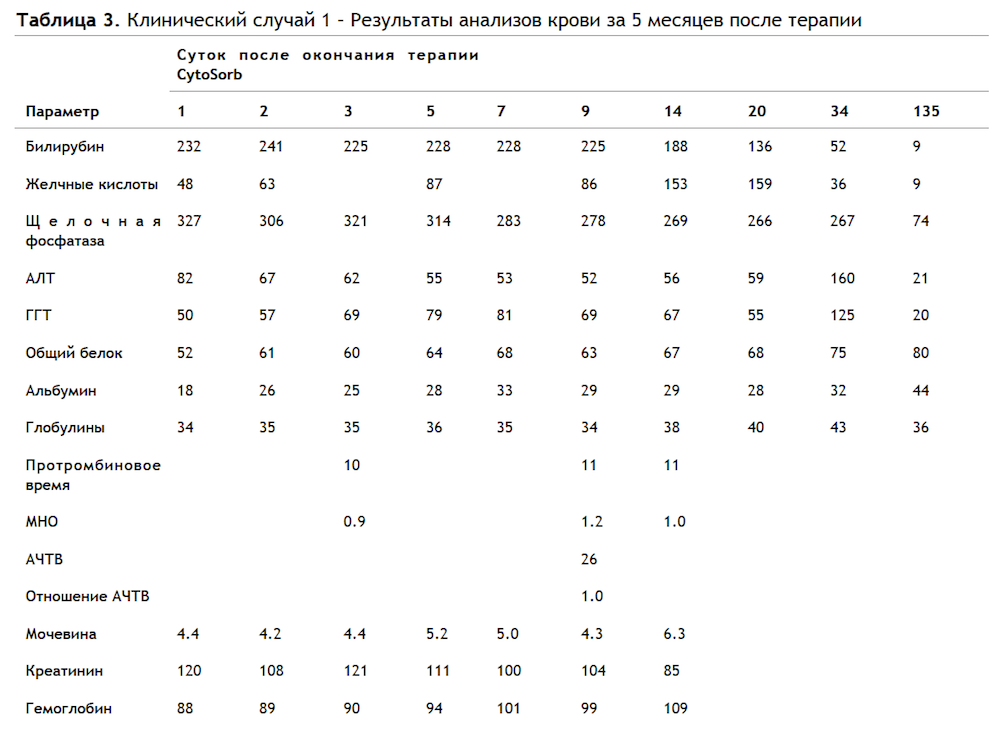
В Таблице 3 приведены результаты анализов крови за 5 месяцев. 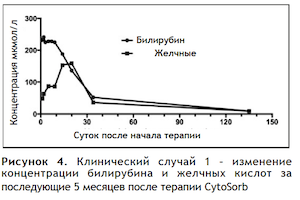 Рисунок 4 иллюстрирует изменение концентраций билирубина и желчных кислот за этот период.
Рисунок 4 иллюстрирует изменение концентраций билирубина и желчных кислот за этот период.
По окончании 5-месячного периода пациент сообщал о нормальном самочувствии, восстановлении аппетита и возобновлении тренировок без «помощи» анаболических стероидов. 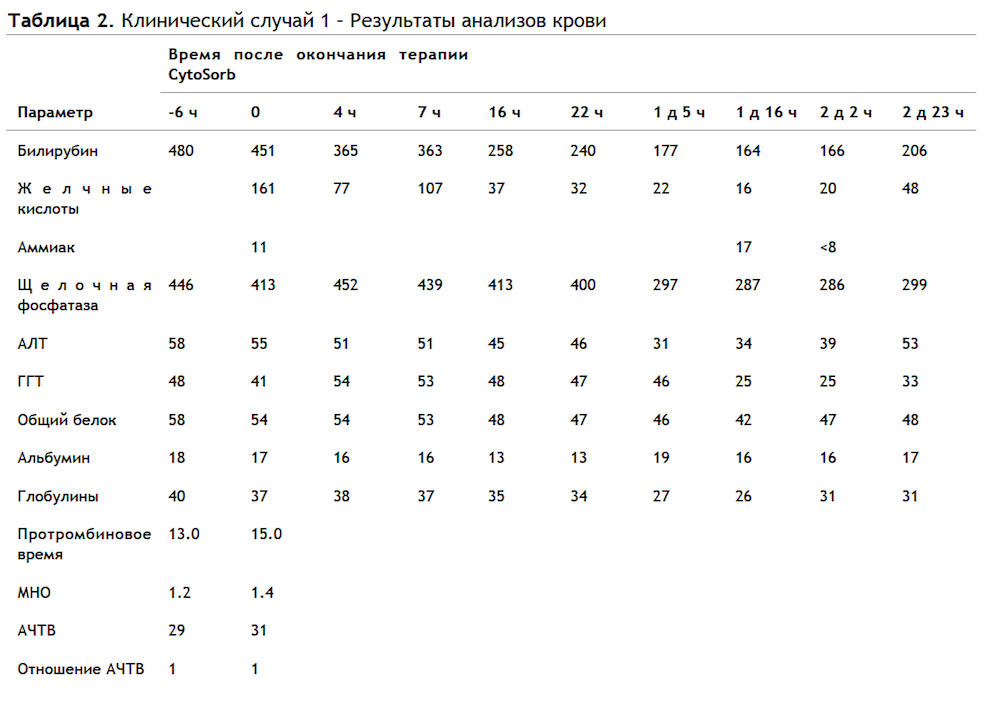
 Клинический случай 2
Клинический случай 2
Пациент: мужчина, 71 год, в анамнезе желтуха, накануне визита к врачу темная моча, прурит, выраженная вялость, снижение аппетита. Недавно пациент закончил 5-дневный курс цефтриаксона внутривенно по причине инфицирования раны на руке. Билирубин в анализе крови 275 мкмоль/л, щелочная фосфатаза 339 Ед/л, МНО 1.1.
Визуализация печени не выявила очаговых поражений или расширения желчных протоков. Был поставлен диагноз цефтриаксон - индуцированный желчный холестаз. Трансюгулярная биопсия печени подтвердила холестаз и неспецифическое портальное воспаление, скорее всего, фармакологический этиологии. В течение следующего месяца наблюдения за пациентом в стационаре концентрация билирубина возросла до 608 мкмоль/л, пациент потерял в весе, прурит прогрессировал. Мужчину перевели в ОРИТ для проведения терапии CytoSorb, было получено информированное согласие. Адсорбер CytoSorb был подключен в контур аппарата Prismaflex, как показано на Рисунке 1, параметры процедуры изложены в Таблице 1. В общей сложности пациенту провели 49 часов терапии CytoSorb (первый сеанс - 23 часа, затем перерыв на 4 часа, далее еще 26 часов). Дополнительно измеряли желчные кислоты и IL-6. Результатыанализов приведены в Таблице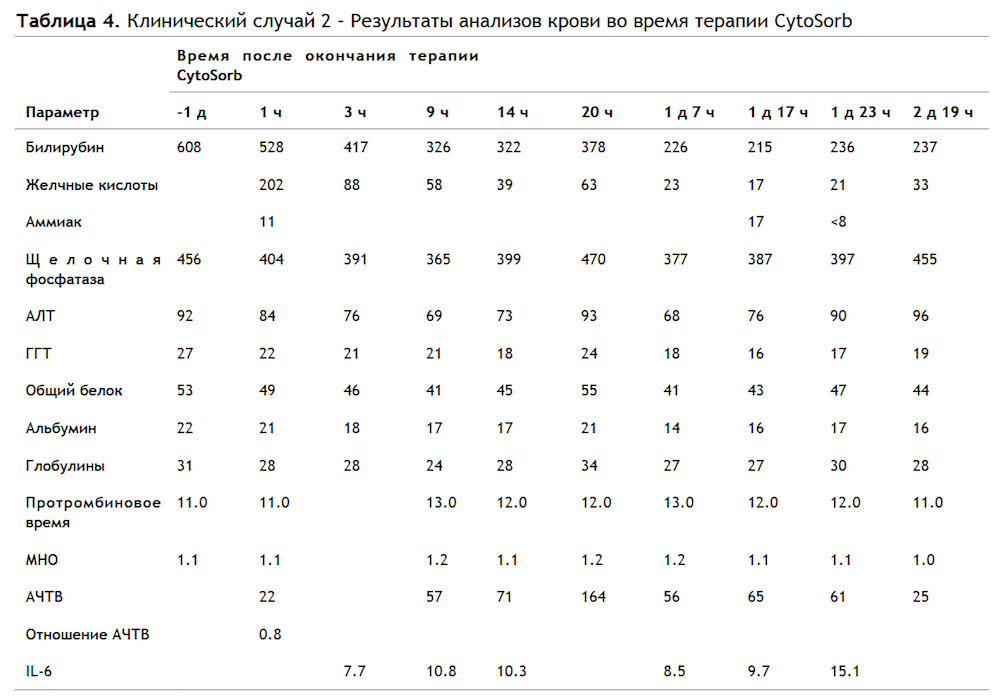 4
4
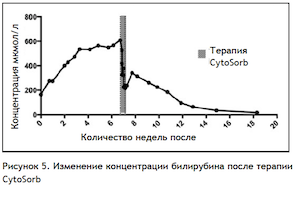 Через 2 часа после окончания терапии CytoSorb у пациента наблюдалось локальное кровотечение из места установки бедренного катетера, открывшееся во время дефекационных потуг. Кровотечение остановлено путем компрессии, выполнена инфузия жидкости. На следующие сутки во время перевода из ОРИТ концентрация гемоглобина снизилась со 115 до 83 г/л, зарегистрировано повышение концентрации креатинина со 127 до 157 мкмоль/л. Еще через сутки пациента выписали из стационара. В Таблице 5 приведены результаты анализов крови за последующие 3 месяца. Рисунок 5 иллюстрирует изменения концентрации билирубина и желчных кислот за тот же период. Несмотря на кратковременное повышение концентрации билирубина и желчных кислот после окончания терапии, они более не повышались до значений, зарегистрированных у пациента до начала терапии CytoSorb. Через 2,5 месяца после выписки эндогенная функция печени полностью восстановилась.
Через 2 часа после окончания терапии CytoSorb у пациента наблюдалось локальное кровотечение из места установки бедренного катетера, открывшееся во время дефекационных потуг. Кровотечение остановлено путем компрессии, выполнена инфузия жидкости. На следующие сутки во время перевода из ОРИТ концентрация гемоглобина снизилась со 115 до 83 г/л, зарегистрировано повышение концентрации креатинина со 127 до 157 мкмоль/л. Еще через сутки пациента выписали из стационара. В Таблице 5 приведены результаты анализов крови за последующие 3 месяца. Рисунок 5 иллюстрирует изменения концентрации билирубина и желчных кислот за тот же период. Несмотря на кратковременное повышение концентрации билирубина и желчных кислот после окончания терапии, они более не повышались до значений, зарегистрированных у пациента до начала терапии CytoSorb. Через 2,5 месяца после выписки эндогенная функция печени полностью восстановилась.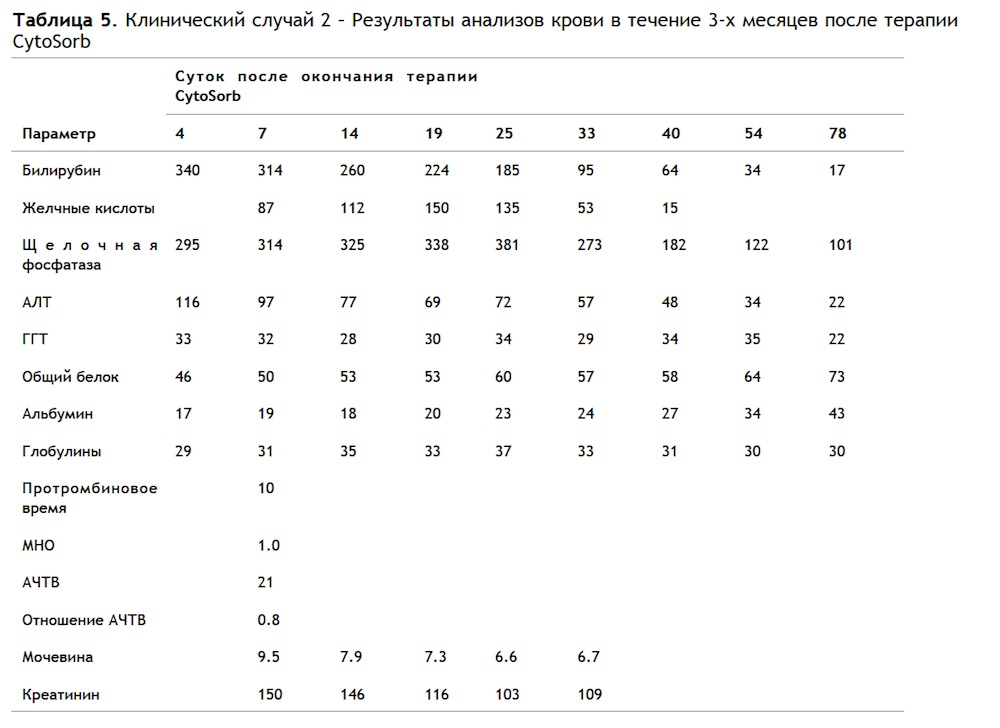
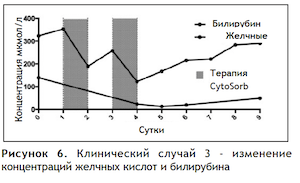 Клинический случай 3
Клинический случай 3
Пациент*, 54 года, поступил в ОРИТ в связи с прогрессирующим алкогольным гепатитом ОпечН на фоне хронической недостаточности функции печени и последующей ПОН (энцефалопатия, гипотензия и олигурия). Пациент интубирован, начала ИВЛ, вазопрессорная поддержка, кортикостероиды, антибактериальная терапия широкого спектра в надежде на восстановление функции печени. Риск смертности в течение 3 месяцев: 83% по шкале MELD. Функция почек регрессировала на фоне гепаторенального синдрома, начата продленная ЗПТ (1800 мл/ч-1 в режиме гемодиафильтрации).
(Прим. переводчика: пол пациента в публикации не указан) 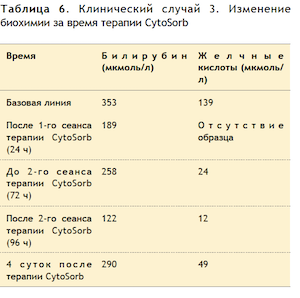
Тяжесть клинической картины (ОпечН, тяжелое течение желтухи, энцефалопатия) и наличие уже установленного экстракорпорального контура обусловили решение о применении терапии CytoSorb. Каждая сессия терапии CytoSorb (всего было проведено 2 сеанса терапии CytoSorb) продолжалась около 24 часов (методология описана выше). Изменения в биохимии крови приведены ниже в Таблице 6 и иллюстрированы в Рисунке 6. К сожалению, несмотря на агрессивную симптоматическую терапию, функция почек не восстановилась, гипотензия сохранялась. Активную терапию прекратили на 15-е сутки после поступления пациента в ОРИТ.
Дискуссия
Мы описали применение CytoSorb для адсорбции токсинов печени во время симптоматической терапии, направленной на восстановление эндогенной функции печени. Пациенты в клинических случаях 1 и 2 не имели предшествующих поражений печени, пациент 3 находился в критическом состоянии с диагнозом острый алкогольный гепатит и ОпечН на фоне хронического нарушения функции печени. Во всех трех случаях в результате терапии CytoSorb наблюдалось выраженное снижение концентрации билирубина (в среднем на 50% за 24 часа терапии CytoSorb) и еще более выраженное снижение концентрации желчных кислот. У пациентов в сознании это снижение ассоциировалось с улучшением клинической картины и самочувствия. Мы считаем, что терапия CytoSorb должна рассматриваться как мера обретения контроля над разбалансировкой биохимических показателей; заявлять о том, что CytoSorb может позволить восстановить эндогенную функцию печени или служить «мостом» в ожидании трансплантации печени, пока рано – для этого потребуются соответствующие рандомизированные контролируемые исследования. Однако, адсорбция токсинов печени оказывает прямое или косвенное положительное влияние на дисфункцию печени, например, хотя бы, напрямую способствуя сокращению церебрального отека. Этот тезис соответствует экспериментам на животных моделях и позволяет предположить, что снижение концентрации токсинов печени ассоциируется с более быстрым восстановлением эндогенной функции печени. Такое мнение весьма распространено среди клиницистов(9). ОпечН – результат целого комплекса синдромов: разрегуляции воспалительной реакции, вазопареза, бактериальной транслокации в результате «простого» накопления токсинов печени. В связи с этим, улучшение клинического исхода при ОпечН – это, скорее, сочетание эффективных терапевтических мер, оптимальной поддержки органов и систем и своевременного решения вопроса о трансплантации, нежели чем какой-то один вид терапии, например, такой, как экстракорпоральная детоксикация(10–12). Возможность поддержки экскреторной функции печени представляет собой терапевтическую методику, ранее не распространенную в ОРИТ. Поддержку экскреторной функции организма призваны оказывать самые разные виды терапии, например, ИВЛ при ОРДС, продленная ЗПТ при ОПН. Конечно, каждая система и орган требуют особо вида поддержки (например, ацидоз при ОПН не поддается терапии с помощью ИВЛ), однако, до настоящего времени такого особого вида вспомогательной терапии для экскреторной функции печени не существовало. Как описывалось ранее, продленная ЗПТ практически не работает в части клиренса токсинов печени, аккумулируемых при печеночной недостаточности, так как они связаны с белками и/или жирорастворимы. При этом стоит выделить аммиак, который хорошо удаляется с помощью продленной ЗПТ, которая дает возможность (так как экстракорпоральный контур уже установлен) расширить заместительную почечную терапию до гепаторенальной заместительной терапии, что, по нашему мнению, является крайне привлекательной методикой. Эта комбинация, конечно, не является поддержкой синтетической функции печени, она просто замещает часть ее экскреторного функционала. Однако, так же, как и экстракорпоральное удаление CO2, подобная терапия может инициировать большой шаг вперед в философии ОРИТ – рисуется искушающая картина комбинированной экстракорпоральной респираторной, ренальной и печеночной экскреции с относительно небольшими модификациями каждой из перечисленных модальностей. В настоящее время технологии, замещающие синтетическую функцию печени, находятся на стадии тестирования и оценки, и, скорее всего, будут недоступно дорогими (в большинстве случаев 80 000 фунтов стерлингов за сеанс терапии), кроме того, для проведения подобной терапии требуется перфузиолог(14). Клинический случай 3 описывает применение CytoSorb в случае алкогольного гепатита и ОПН. Агрессивная стандартная терапия этого пациента включала в себя, кроме кортикостероидов, продленную ЗПТ, так что, экстракорпоральный контур был уже установлен этому пациенту. Первичной целью терапии в этом случае было восстановление эндогенной функции печени, поэтому, имея возможность путем небольшого добавления в экстракорпоральный контур достичь адсорбции накапливающихся токсинов печени, мы приняли решение использовать этот шанс. Прогноз в этом клиническом случае был негативным, однако терапия печеночной дисфункции претерпела значительные изменения за последнее время. Исследование Stopah продемонстрировало, что применение кортикостероидов может снижать летальность в краткосрочной перспективе. CytoSorb был призван выступить в поддержку терапии кортикостероидами, так как пациент не являлся подходящим кандидатом для трансплантации. В настоящее список поддерживающих терапевтических методик, которые клиницисты могут применять наряду с поддерживающей терапией, не так уж велик: потенциально экстракорпоральная поддержка печени с помощью CytoSorb, кортикостероиды(15), вазопрессоры, поддержка органов и систем (терлипрессин и альбумин(16)), рифаксимин для коррекции энцефалопатии(17). На практике при ОПечН всегда используется комбинация подобных методик, так как в большинстве случаев поражение печени ведет к ПОН. Всеобъемлющий обзор экстракорпоральных методик выходит за рамки настоящей публикации, он подробно изложен в других работах(18). Доступные на рынке медицинского оборудования системы немногочисленны, при этом достаточно сложны и дороги. Система MARS (GAMBRO™) описана наиболее подробно и лучше всех нам знакома, однако, она очень высоко специализирована и дорогостояща: стоимость комбинированной поддержки функции печени и почек составляет 2000 фунтов стерлингов в сутки(1). Несмотря на то, что этот вид терапии считается безопасным, она находится на рассмотрении UK NICE в части недоказанной эффективности и высокой стоимости(19). Другие системы, например, Prometheus (Fresenius) и альтернативы, например, плазмаобмен или альбуминовый диализ одного перехода диализата (SPAD) имеют на сегодняшний день еще менее всеобъемлющую оценку. Наш коллектив ранее исследовал альбуминовую фильтрацию high-flux, при которой скорости клиренса билирубины сравнимы с CytoSorb и MARS20. Адсорбер CytoSorb изначально позиционировался как средство вспомогательной терапии для больных с сепсисом, мы ранее описывали наш опыт в этой связи(2). Адсорбер, заполненный горошинами полимера, напоминает компонент системы MARS для анионного обмена, кроме того, команда Cytosorbents оповестила нас о том, что адсорбция токсинов печени будет иметь место при клиническом применении CytoSorb. Текущая стоимость экстракорпорального контура составляет около 70 фунтов стерлингов, стоимость колонки CytoSorb 1250 фунтов стерлингов, что в сумме гораздо меньше сумм, перечисленных выше. CytoSorb требует более длительных исследований безопасности в связи с необходимостью установки пациенту экстракорпорального контура. Там, где наличие экстракорпорального контура требуется для других методик (например, продленная ЗПТ), риск снижается. Во втором клиническом случае, например, открывшееся кровотечение из места установки катетера было связано не с применением CytoSorb, а являлось следствием установки ЦВК, тяжелого геморроя и потуг. В обоих случаях наблюдалось повышение концентрации креатинина, однако эта проблема с течением времени (в течение 2-х месяцев) аутокорректировалась без нашего вмешательства. Механизмы подобной реакции следует изучить, и при этом нельзя отрицать повышение мышечного катаболизма при продолжительном постельном режиме. Однако, вполне логичным кажется, что повреждение почек возникло, например, вследствие сниженного почечного кровотока или изменения механизма обратной канальцево-клубочковой связи, поэтому следует обращать внимание на почечные последствия применения CytoSorb. Обобщая вышесказанное, для случаев, в которых ожидается выздоровление, или когда трансплантация не является клинически оправданной, а также в случаях, когда контур для продленной ЗПТ уже установлен, клиницисты могут рассмотреть применение CytoSorb в качестве удобного и эффективного средства снижения интенсивности желтухи и удаления желчных кислот. Профиль безопасности CytoSorb в экстракорпоральном контуре представляется обоснованным, однако, требует более полной оценки.
Конфликт интересов
Авторы заявляют о следующем конфликте интересов в связи с настоящей публикацией: адсорберы CytoSorb были куплены (не предоставлены бесплатно). Советы по техническим аспектами использования колонки, полученные от компании Cytosorbents, никоим образом не диктовали выбор терапии пациента и не явились основанием для написания настоящей работы. Никто из авторов не получил финансовой поддержки от Cytosorbents или других компаний.
Финансирование
Авторы не получали финансовой поддержки настоящего исследования, авторства и публикации настоящей статьи.
Информированное согласие пациентов
Получено от пациентов Клинических случаев 1 и 2, а также от родственников пациента из Клинического случая 3.
Ссылки
1. http://cytosorb-therapy.com/ (accessed 3 October 2017).
2. Morris C, Gray L, and Giovannelli M. Early report: the use of CytosorbTM haemabsorption column as an adjunct in managing severe sepsis: initial experiences, review and recommendations. J Intensive Care Soc 2015; 3: 257–264.
3. Kogelmann K, Jarczak D, Scheller M, et al. Hemoadsorption by CytoSorb in septic patients: a case series. Crit Care 2017; 21: 74.
4. https://www.nice.org.uk/advice/mib87/ (2016, accessed 30 September 2017).
5. http://www.cytosorb-registry.org/publikationen-2/?lang=en (accessed 3 October 2017).
6. http://vitaltherapies.com/elad/technology/ (accessed 03 October 2017).
7. Tomescu DR, Olimpia Dima S, Ungureanu D, et al. First report of cytokine removal using CytoSorb® in severe noninfectious inflammatory syndrome after liver transplantation. Int J Artif Organs 2016; 39: 136–140.
8. Faltlhauser A, and Kullmann F. Use of hemoadsorption in a case of severe hepatic failure and hyperbilirubinemia. Blood Purif 2017; 44: 98–99.
9. Zieve L, Shekleton M, Lyftogt C, et al. Ammonia, octanoate and a mercaptan depress regeneration of normal rat liver after partial hepatectomy. Hepatology 1985; 5: 28–31.
10. Kramer L, and Kodras K. Detoxification as a treatment goal in hepatic failure. Liver Int 2011; 31: S1–S4.
11. Hernaez R, Sola E, and Moreau R. Acute on chronic liver failure: an update. Gut 2017; 66: 541–553.
12. Verbeke L, Nevens F, and Laleman W. Bench to bedside review: acute on chronic liver failure. Linking the gut, liver and systemic circulation. Crit Care 2011;15: 233.
13. https://clinicaltrials.gov/ct2/show/NCT02654327 (accessed 3 October 2017).
14. https://www.organ-assist.nl/products/liver-assist (accessed 3 October 2017).
15. Thrursz MR, Richardson P, Allison M, et al. for the Stopah Trial. Prednisolone or pentoxifylline for alcoholic hepatitis. N Engl J Med 2015; 372: 1619–1628.
16. Gludd LL, Christensen K, Christensen E, et al. Terlipressin for hepatorenal syndrome. Cochrane Database Syst Rev 2012; 9: CD005162.
17. Bass NM, Mullen KD, Sanyal A, et al. Rifaximin treatment in hepatic encephalopathy. N Engl J Med 2010; 362: 1071–1081.
18. Stange J. Extracorporeal liver support. Organogenesis 2011; 7: 64–73.
19. Extracorporeal albumin dialysis for acute liver failure. Interventional procedures guidance [IPG316], https:// www.nice.org.uk/guidance/ipg316/chapter/1-Guidance (2009, accessed 3 October 2017).
20. Morris C, and Rogerson D. The use of high-flux albumin haemofiltration (HFAF) with Evaclio EC-2CTM in the management of liver failure as a bridge to transplantation. J Intensive Care Soc 2011; 12: 228–233.
Ключевые слова: недостаточность функции печени, холестаз, алкогольный гепатит, стероиды, интоксикация, передозировка лекарств, цефтриаксон
Похожие публикации по теме:
- CytoSorb при интоксикации. Подборка публикаций
- Клиническая эффективность комбинации гемодиализа и гемоперфузии с помощью CytoSorb при рабдомиолизе на фоне передозировки кокаина
- Применение CytoSorb в терапии интоксикации галюциногенными грибами Psilocybe cubensis
- Терапия тяжелой намеренной передозировки кветиапина с помощью CytoSorb в режиме гемоперфузии
- Применение CytoSorb в терапии интоксикации галлюциногенными грибами Psilocybe cubensis
- Применение CytoSorb при интоксикации МДМА (экстази): первое применение in-vivo (на человеке) и исследование in-vitro
- Успешное применение экстракорпорального жизнеобеспечения (ваЭКМО), внутривенной инфузии липидов и CytoSorb при интоксикации венлафаксином и кардиомиопатии такоцубо
- Гемосорбция повышает выживаемость крыс, подвергнутых воздействию летальной дозы афлатоксина B1